臨床試験には大きく分けて、治験 と 治験以外の臨床試験とがあります。
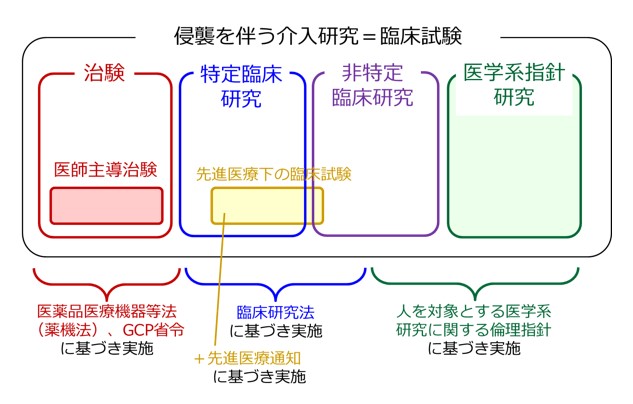

「治験」とは、厚生労働省による新薬としての承認を得ることを目的とし、未承認薬を用いて主に製薬企業が主体となって行う臨床試験で、これまで患者さんに使われたことのない新しい薬、あるいはこれまでその病気では使われたことのない薬の安全性や有効性を調べる臨床試験です。医師自らが主体となって実施する「医師主導治験」もあります。厚生労働省による承認が得られたら、企業が薬を販売し、認められた病気の範囲内で一般に使えるようになるのです。
一方、治験以外の臨床試験は、主に研究者(医師)が主体となって行うものです。未承認または既承認の医薬品や医療機器を用いた治療法や診断法を対象として、その中から最良の治療法や診断法を確立すること、薬のよりよい組み合わせを確立することなどを目的としています。また、医薬品医療機器等法の対象とはならない医療行為、例えば手術や放射線治療などは、製薬企業による治験では開発が進みませんので、そのような医療上の課題を研究者(医師)が主体となって臨床試験を行うこともあります。治験以外の臨床試験には、臨床研究法、先進医療通知、人を対象とする医学系研究に関する倫理指針の対象となるものがあります。
「治験」が薬そのものの安全性や有効性を調べることを目的としていることが多いのに対し、「研究者(医師)主導の臨床試験」で医薬品の評価を行う場合には、そのような薬も含め、時には手術や放射線療法などとの組み合わせも考えて、患者さんにどのような治療を行うのが良いのか、治療法の安全性や有効性を調べることを目的としていることが多いという違いがあります。