FAQ
臨床研究法・CRB手続き
新規申請
変更申請
管理者許可申請
提出書類について
1-3 COI管理様式
2-2 研究分担医師リスト
3-2 実施計画別紙
書類提出(アップロード)
案内メール、リマインドメールに関する質問
説明文書・同意書
システム(ファイル管理ツール等)
実施途中からの試験参加(追加施設)
参加取り下げ
臨床研究法・CRB手続き
新規申請
| 質問 | 回答 | |
|---|---|---|
| 1 |
機関内のCOI事実確認で、プロトコールと説明文書が必要ですので、ファイルを送ってください。 |
研究事務局から送付される、CRBへの申請手続きに関わる案内メールに、ファイル共有ツールのリンクが記載されています。プロトコールと説明文書はファイル共有ツールからダウンロードしてください。 |
変更申請
| 質問 | 回答 | |
|---|---|---|
| 2 |
数か月後に研究者の異動予定があります。今、CRB変更申請手続きの案内が届いていますが、研究責任医師や研究分担医師の追加や削除を行ってよいですか? |
すでに異動が決まっている研究者は今回の変更申請で手続きしてください。 |
| 3 |
変更申請のCRB提出書類をアップロードして提出しましたが、その後に提出を求める督促メール(メール件名:【臨床研究法リマインド】)が届きました。 |
該当するメールでお伝えしている情報には、申請内容によって以下の2つのパターンがあります。 |
| 4 |
今回の変更申請で研究分担医師を追加するため書類を提出しました。CRBで承認されるまでの間に「研究支援者」として登録すれば同意取得を行ってもよいでしょうか。 |
同意取得はCRBで承認された研究責任医師または研究分担医師でなければ行うことができません。 |
| 5 |
現在、研究責任医師1名と研究分担医師1名の2名体制で実施しています。研究分担医師が異動することになったので、研究分担医師を削除して、研究責任医師1名のみとしてよいですか? |
研究分担医師は1名以上を配置してください。 |
| 6 |
プロトコールと説明文書の両方の改訂がCRBで承認されました。 |
プロトコールの改訂内容は、CRB承認後に各実施医療機関の管理者の許可を得て、その後にjRCTで公表されると発効されます。JCOG試験では管理者許可を得ていただく期間として2週間程度を確保していますので、この間に速やかに管理者の許可を得てください。 |
| 7 |
つい先月、当該試験の変更申請について管理者許可を得たところです。今回、研究事務局より次の変更申請の案内メールを受領しました。 |
JCOG試験の1回の変更申請にかかる期間は、各施設での書類作成に必要な期間やCRBの審査期間も含めて約半年で、基本的に年2回を予定しています。そのため、前の変更申請が終わった直後に次の変更申請の案内が届きます。 |
| 8 |
今月から当院に新たに医師が着任しました。早速、研究分担医師に追加したいので、変更申請に必要な書類の提出を進めてもよいでしょうか。 |
各試験の研究事務局からグループメーリングリストを通じて連絡される変更申請の案内メールがあるまで手続きはせずにお待ちください。 |
| 9 |
再来月から当院の「施設名」が変更されます。現在作成中の変更申請の提出書類の締切が来月のため、変更後の施設名を記載して提出したらよいでしょうか。 |
「施設名」の変更について、「保険医療機関名」に変更があるかどうか院内の担当部署にご確認ください。臨床研究法では「保険医療機関名」をCRB提出書類に記載して提出していますので、「保険医療機関名」に変更がある場合は、「保険医療機関名」の変更届出が正式に完了後のCRB変更申請で施設名を変更して書類を提出してください(※)。 |
| 10 |
先進医療の試験で、研究責任医師を変更したいです。研究事務局から届いたCRB変更申請の案内メールには、「先進医療の手続きが必要」と記載されていましたが、どうしたらよいでしょうか。 |
研究事務局から届いた案内メールに沿って、変更後の実施計画、研究分担医師リスト、COI管理様式の作成をお願いします。 |
| 11 |
変更申請のCRB提出書類について、当院の手続きが遅れており、期限までに提出できません。 |
提出期限までに間に合わない場合は、今回の変更申請に含めることができません。次回の変更申請のご案内をお待ちください。 |
| 12 |
当該試験の研究グループに所属していない診療科の医師にも参加いただくことは可能でしょうか。 |
はい、可能です。ただし、同意取得等を行う場合は、「研究分担医師」として追加するためCRBへの変更申請が必要です。次回の変更申請のご案内に従って手続きをお願いします。 |
| 13 |
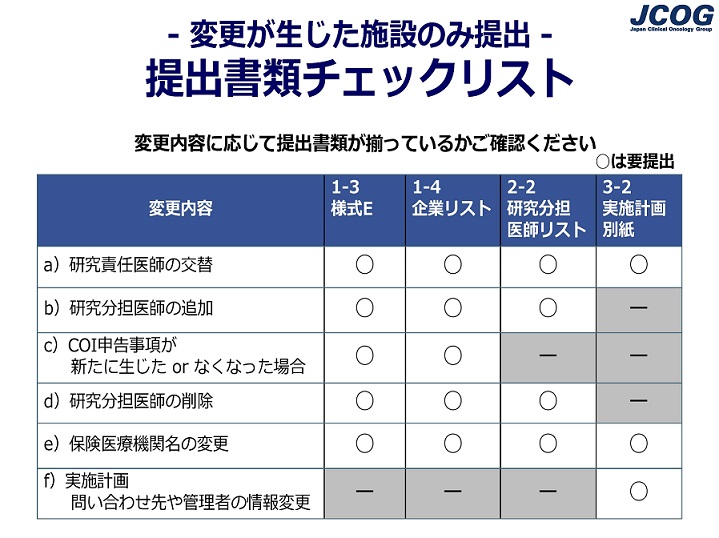
変更申請手続きについて、研究事務局から受領した案内メールに「変更が生じた施設のみ対応」と記載されていました。前回から変更はないと思いますが、書類の提出が必要かどうか、心配です。 |
【変更が生じた施設のみ対応する場合】 |
 |
||
| 14 |
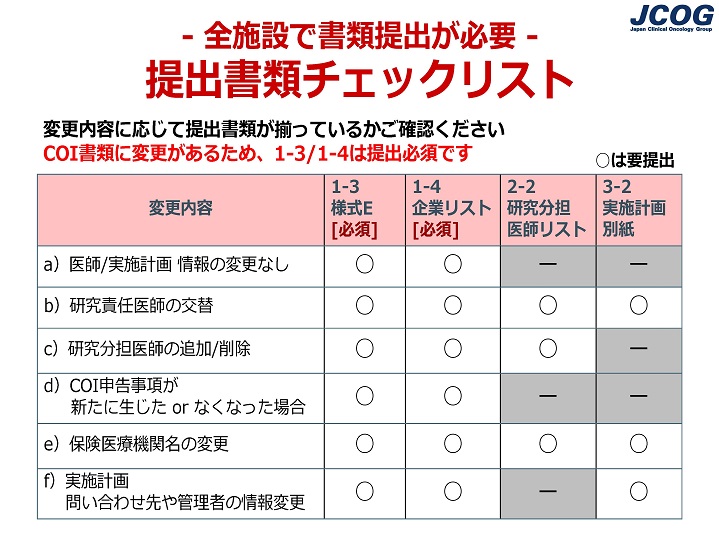
変更申請手続きについて、研究事務局から受領した案内メールに「全参加施設でCOI書類の作成、提出が必要」と記載されていました。COI書類は全施設提出必須とありますが、他の書類も提出が必要でしょうか? |
【全参加施設でCOI書類の作成、提出が必要な場合】 |
 |
||
管理者許可申請
| 質問 | 回答 | |
|---|---|---|
| 15 |
管理者への研究実施許可申請で提出したCRB承認書類の中で「CRB承認日」が未記載の書類があり、承認日を記載するように指示がありました。承認日が記載された書類をください。 |
管理者許可を得ていただく際にご案内している「認定臨床研究審査委員会(CRB)承認書類ダウンロード」ページに掲載している書類は、CRB承認日が記載されていません。 |
| 16 |
これまでCRBで審議された審査書類を入手する方法をおしえてください。 |
新規申請や変更申請のCRB審査書類は専用のCRB承認書類ダウンロードページに掲載していますので、下記サイトからダウンロードしてご利用ください。 |
| 17 |
研究事務局から受領した案内メールで「各実施医療機関の管理者に厚生労働大臣へ実施計画を提出した旨の報告が必要」とあります。 |
臨床研究法施行規則に従ってご案内しています(臨床研究法施行規則 第39条 第4項)。 |
| 18 |
臨床研究法では全施設で同じ説明同意文書を用いなければならないと聞いています |
施設ごとに変更可能な章は、施設の情報を反映して選択、追記してから、管理者許可を得てください。許可が得られた文書を実際に使用していただきます。 |
| 19 |
CRB承認書類の中の説明文書、同意書の後ろに「別紙:臨床試験に伴う副作用・合併症について」がついています。この文書についても管理者許可を得る必要がありますか。また、管理者許可を得る必要がある場合、当施設で使うファイルはどこにありますか。 |
別紙も説明文書、同意書とあわせて患者さんへ渡す書類となりますので、管理者許可を得てください。 |
| 20 |
jRCTに公開される時期(改訂発効となる時期)はいつでしょうか。 |
CRBで承認され、その後に各実施医療機関で実施許可を得ていただきます。その後、jRCTで公表されると、グループメーリングリストを通じて周知されますので案内メールをお待ちください。 |
| 21 |
書類を作成し、当科の担当者がJCOGへ提出しましたが、提出者が異動となった関係で、CRBへの最終提出書類が分からなくなってしまいました。自施設の管理者許可を得る際に、様式Eの提出が必要と言われていますが、どうしたらよいですか? |
CRBで承認された各施設のCOI管理様式Eと企業リストについては、「JCOGファイル管理ツール」 内に施設ごとに保存しています。下記URLより、ログインのうえ、ご自身の施設の最終版ファイルをダウンロードしていただき、管理者の研究実施許可を得てください。 |
提出書類について
1-3 COI管理様式
| 質問 | 回答 | |
|---|---|---|
| 22 |
COI管理様式の様式Cについて教えてください。前年度、今年度について申告しますが、年度の区切りは決まっていますか? |
一般に、COI申告の年度は「4月1日~3月31日」となります。 |
| 23 |
【変更申請】 |
JCOG運営事務局へ提出する様式Eには、既に提出済みの他の分担医師と、今回追加となる医師をすべて記載してご提出ください。 |
| 24 |
COI管理様式の様式Eを提出しようと思いますが、様式Cなどの他のシートを削除しようとすると、様式Eの記載もリンクが反映されず、消えてしまいます。どうすればいいでしょうか。 |
JCOG運営事務局へ提出するCOI管理様式は様式E以外のシートが含まれたまま提出いただいて差し支えありません。CRBには各施設の様式Eのみ提出します。 |
| 25 |
当院の研究責任医師と研究分担医師は計16名を超えていて、様式Eの記載欄に全員を記載できません。どうしたらよろしいでしょうか。 |
様式Eの1つのファイルに記載できる研究責任医師と研究分担医師は計16名までです。17名以上となる場合、2つのファイルに分けて作成してください(1つのファイルに様式Eのシートは追加しないでください)。 |
| 26 |
院内のCOI事実確認の結果、研究責任医師が「基準1と4と5」に該当しました。 |
JCOG試験の審査を行うCRBの方針で「基準1と4と5」に該当する研究責任医師は、原則、研究責任医師になることができません。 |
| 27 |
【変更申請】 |
企業リストに変更がありますので、COI管理様式Eと企業リストの提出が必要です。 |
| 28 |
【変更申請】 |
はい、書類の提出は必要ありません。 |
2-2 研究分担医師リスト
| 質問 | 回答 | |
|---|---|---|
| 29 |
役割登録画面で役割を選択したいのですが、役割のボタンを押すことができません。 |
役割登録の設定を行えるユーザーは、該当するグループの「施設研究責任者」、「施設コーディネーター」、当該試験の「研究責任医師」のみとなります。 |
| 30 |
研究分担医師を追加したいです。 |
「CRBによる承認」欄はCRB承認後に承認済となります。申請前は空欄のままで問題ありませんので、研究分担医師リストダウンロードボタンより、研究分担医師リストを作成し、提出をお願いいたします。 |
| 31 |
【変更申請】 |
役割登録の設定を行えるユーザーは、該当するグループの「施設研究責任者」、「施設コーディネーター」、当該試験の現在の役割が「研究責任医師」のみです。 |
| 32 |
【変更申請】 |
役割登録画面で追加したい人が表示されない場合は、先に「研究者情報変更 」の手続きが必要です。施設研究責任者、もしくは施設コーディネーターから研究者登録をご申請ください。詳細は、「研究者情報変更 」をご覧ください。 |
| 33 |
役割登録画面から、研究分担医師リストのエクセルファイルをダウンロードしました。新たに研究分担医師に追加したい医師がいるため、エクセルで手入力して追加してもよいですか? |
研究分担医師となるには、JCOGへの研究者登録と、役割登録画面での役割設定が必要となります。エクセルファイルへの手入力による追加はお控えください。 |
| 34 |
【変更申請】 |
役割登録の設定を行えるユーザーは、該当するグループの「施設研究責任者」、「施設コーディネーター」、当該試験の現在の役割が「研究責任医師」のみです。 |
| 35 |
【変更申請】 |
はい。 |
| 36 |
【放射線治療グループと頭頸部がんグループのインターグループスタディですが、当院は頭頸部がんグループからしか参加していません。放射線科の医師を研究分担医師に追加したいですが、どうしたらよいですか? |
ご施設の頭頸部がんグループの研究者に放射線科の医師を追加していただくことが可能です。 |
| 37 |
【変更申請】 |
はい。 |
| 38 |
【変更申請】 |
研究分担医師リストはWeb Entry Systemで必要事項を入力してご作成いただく必要があります。 |
| 39 |
【変更申請】 |
現在の役割は、CRBで変更申請が承認され、その後にjRCTに公表されるまで有効ですので、それまでは患者登録やCRFの入力が可能です。 |
| 40 |
【変更申請】 |
倫理指針に従う試験では、JCOGの研究者登録完了後すぐに、役割の追加が「現在の本試験における役割」に反映されます。 |
| 41 |
jRCT公表、改訂発効の案内メールが届きましたが、今回研究分担医師リストへ追加した医師が担当医として選べません。 |
役割登録画面を開いて、「研究グループ」、「施設」、「該当する試験」を選択していただき、下に表示される「役割の追加/変更/削除画面」を押してください。 |
| 42 |
食道がんグループの試験ですが、プロトコール治療には放射線治療や内視鏡治療も含まれています。当科(消化器内科)の医師以外に、放射線治療科、内視鏡科の医師を研究分担医師として追加したいです |
ご施設の食道がんグループの研究者に放射線治療科や内視鏡科の医師を追加していただくことが可能です。 |
3-2 実施計画別紙
| 質問 | 回答 | |
|---|---|---|
| 43 |
【変更申請】 |
変更手続きは試験ごとに時期を決めて定期的に行っていますので、研究事務局からの変更申請の案内メールをお待ちください。 |
| 44 |
【変更申請】 |
病院長の変更につきまして、試験毎に、実施計画(jRCTに公表される情報)を修正する必要があります。 |
| 45 |
【変更申請】 |
はい。 |
| 46 |
【実施計画の「研究に関する問合わせ先」は誰がいいのでしょうか。施設コーディネーターとしたほうがよいですか? |
該当する試験の問い合わせに対応される方を記載してください。研究責任医師や研究分担医師、JCOG施設の施設研究責任者や施設コーディネーターに限りません。機関内に設置されている相談支援センター等があれば、臨床研究に関する患者さん向け相談窓口の担当者でもかまいません。必ず、担当者の氏名を記載してください。氏名欄に部署名を記載しないでください。 |
書類提出(アップロード)
| 質問 | 回答 | |
|---|---|---|
| 47 |
CRB提出書類をアップロードしましたが、その後に変更点が生じました。 |
更新した書類のみ、前回と同じ方法で再度アップロードをお願いします。 |
| 48 |
胃がんグループと食道がんグループのインターグループスタディでCRB提出書類をアップロードしたいのですが、胃がんグループと食道がんグループのそれぞれから同一書類を提出したらよいですか? |
どちらか一方のグループから1回アップロードをお願いします。 |
| 49 |
新規申請や変更申請に必要な提出書類をアップロードしました。アップロードできているかどうか心配なので、自分で確認する方法をおしえてください。 |
アップロードできているかどうかは、以下のいずれかでご確認ください。 |
案内メール、リマインドメールに関する質問
| 質問 | 回答 | |
|---|---|---|
| 50 |
当院は「JCOG協力施設」となり、当該試験で患者登録がなく、前回の変更申請で参加取り下げがCRBで承認されました。 |
当該試験の参加取り下げがCRBで承認された後も、他のJCOG試験にご参加いただいていて、グループメーリングリストのメンバーとして登録されている間は、グループメーリングリストを通じてご案内されるメールを止めることはできません。 |
| 51 |
当院が参加していない試験について、CRB申請に関わる案内メールや督促メールが届きます。 |
他のJCOG試験にご参加いただいていて、グループメーリングリストのメンバーとして登録されている間は、グループメーリングリストを通じてご案内されるメールを止めることはできません。 |
| 52 |
グループメーリングリストにメンバーとして含まれていないため、CRB申請に必要な案内メールが届きません。 |
ご施設内でメールを受領できている研究者にメールの転送を依頼してください。 |
説明文書・同意書
| 質問 | 回答 | |
|---|---|---|
| 53 |
説明文書の「プライバシーの保護について(個人情報)」の章で、イニシャル、生年月日、診療録番号について、選択肢が設けられています。 |
選択肢は、基本的に従来のご施設の方針と同じ項目をご選択ください(※)。選択事項①、②、③はCRBで承認された記載のため、選択事項の記載内容の変更はできません。 |
| 54 |
臨床研究法では全施設で同じ説明同意文書を用いなければならないと聞いています。 |
施設ごとに変更可能な章は、施設の情報を反映して選択、追記してから、管理者許可を得てください。許可が得られた文書を実際に使用していただきます。 |
| 55 |
CRB承認書類の中の説明文書、同意書の後ろに「別紙:臨床試験に伴う副作用・合併症について」がついています。この文書についても管理者許可を得る必要がありますか。また、管理者許可を得る必要がある場合、当施設で使うファイルはどこにありますか。 |
別紙も説明文書、同意書とあわせて患者さんへ渡す書類となりますので、管理者許可を得てください。 |
システム(ファイル管理ツール等)
| 質問 | 回答 | |
|---|---|---|
| 56 |
CRB承認書類が掲載されている「CRB承認書類ダウンロードページ」や当院のCOI管理様式Eが保存されている「JCOGファイル管理ツール」のサイトでログインができません。 |
JCOGへ施設研究者登録されている研究者がログイン可能となります。EDCでデータ入力される時と同じように JCOG Web Entry System のアカウント(登録メールアドレス)とパスワードでログインをお願いします。 |
| 57 |
JCOGファイル管理ツールを利用したいのですが「ユーザー名」と「パスワード」が要求されます。アカウントを作成する手続きをおしえてください。 |
JCOGの研究者登録がされている方は、EDCやWeb Entry Systemをご利用いただく際と同じ「ユーザー名」(メールアドレス)と「パスワード」をご利用ください。 |
| 58 |
JCOG Web Entry Systemの役割登録画面やJCOGファイル管理ツールを開きましたが、画面に表示されるボタンが押せません。画面の体裁も少しおかしいようです。どうしたらよいですか? |
使用されているブラウザがサポート対象外のものですと、動作が不安定になるようです。(画面の表示がずれたり、ボタンが押せない、ファイルがダウンロードできない、などの事例があります) |
実施途中からの試験参加(追加施設)
| 質問 | 回答 | |
|---|---|---|
| 59 |
新たにJCOG参加施設となりました。臨床研究法に従う試験に参加予定です。手続きについておしえてください。 |
臨床研究法に従う試験では、施設追加についてCRBに変更申請して承認を得る必要があります。CRBの変更申請の時期は試験毎に異なりますので(1年に2回が目安)、研究事務局からの案内メールをお待ちください。 |
| 60 |
新規申請の際、書類提出が期限に間に合いませんでした。試験に参加したいですが、どうしたらよいですか? |
新規申請が完了した後に行う変更申請の際に、追加で申請していただけます。変更手続きは試験ごとに時期を決めて定期的に行っていますので、研究事務局からの変更申請の案内メールをお待ちください。 |
参加取り下げ
| 質問 | 回答 | |
|---|---|---|
| 61 |
当院は「JCOG協力施設」となり、当該試験で患者登録はありません。 |
変更申請の案内メールに、ご施設が取り下げする施設として記載されている場合、今回のCRB変更申請で貴院の参加取り下げを申請しますので、書類の作成は不要です。CRBで参加取り下げが承認されましたら、研究事務局を通じてご連絡しますので、管理者への報告を進めてください。 |
| 62 |
当院は「JCOG協力施設」となり、当該試験で患者登録があります。 |
JCOG協力施設となった後も、患者登録がある試験では試験が終了するまでご参加いただきます。 |
その他のページ
- TOP
- 【臨床研究法】本体研究の認定臨床研究審査委員会(以下「CRB」)承認と登録開始手続き
- 【人を対象とする生命科学・医学系研究に関する倫理指針】本体研究の一括審査IRB承認と登録開始手続き
- 【人を対象とする医学系研究に関する倫理指針】本体研究の施設IRB承認と登録開始手続き
- バイオバンクのIRB承認と登録開始手続き
- 附随研究のIRB承認と登録開始手続き
- PET/CT装置で撮像されたCT画像を適格性の判断や効果判定に用いる場合の手続き
- 患者登録
- CRF提出
- 定期モニタリング/追跡調査
- 有害事象報告/疾病等報告
- 施設訪問監査の受け入れ
- 研究グループメーリングリスト
- 研究者情報変更
- 医療機関情報変更/施設情報変更
- 副次的解析と附随研究
- FAQ