バイオバンクへ参加するかどうかは試験毎に決められます。当該試験がバイオバンクに参加しているかどうかはプロトコール15章をご覧いただくか、研究事務局にお問い合わせください。
バイオバンクへ試料登録するためには、各施設の規定に従って、各医療機関のIRB(倫理審査委員会など)による「JCOG-バイオバンク・ジャパン連携バイオバンク実施計画書(患者説明文書を含む)」の承認を得る必要があります。
既に他のJCOG試験で共通バンキング「JCOG-バイオバンク・ジャパン連携バイオバンク実施計画書」をご審査いただいている可能性もありますので、審査の形態については、各医療機関のIRB事務局などとご相談ください(詳細はFAQをご覧ください)。
IRB承認が得られた際には、 『CRB/IRB・バイオバンク承認書類申請・確認画面』にて、1.送信元情報を確認、2.承認連絡情報を入力、3.ファイルアップロードよりIRB承認書などのファイルをアップロードのうえ、「提出」ボタンを押してご提出ください。JCOGデータセンターから当該グループメーリングリストにて配信された「登録開始手続き完了メール」の受領をもって、患者登録が可能となりますが、バイオバンク試料登録を行うための準備として、
『CRB/IRB・バイオバンク承認書類申請・確認画面』にて、1.送信元情報を確認、2.承認連絡情報を入力、3.ファイルアップロードよりIRB承認書などのファイルをアップロードのうえ、「提出」ボタンを押してご提出ください。JCOGデータセンターから当該グループメーリングリストにて配信された「登録開始手続き完了メール」の受領をもって、患者登録が可能となりますが、バイオバンク試料登録を行うための準備として、 「Web Entry System(https://secure.jcog.jp/dc/)」にログインの上、当該試験のメニュー下部に表示されている「株式会社エスアールエル(SRL)への連絡」または「SRLへの採血管発注専用フォーム」から専用のメールフォームを用いてSRLへ連絡、専用採血管を入手してください。
「Web Entry System(https://secure.jcog.jp/dc/)」にログインの上、当該試験のメニュー下部に表示されている「株式会社エスアールエル(SRL)への連絡」または「SRLへの採血管発注専用フォーム」から専用のメールフォームを用いてSRLへ連絡、専用採血管を入手してください。
詳細は プロトコールダウンロードページに掲載している「JCOG-BBJ連携バイオバンク 共通バンキング参加の手引き」をご覧ください。
プロトコールダウンロードページに掲載している「JCOG-BBJ連携バイオバンク 共通バンキング参加の手引き」をご覧ください。
※IRB承認書の「原本」は自施設で保管ください。
IRB承認と登録開始手順
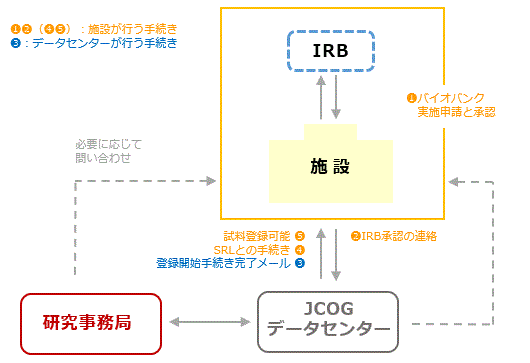
- 当該施設は、当該医療機関のIRBへバイオバンクへの参加につき審査申請し※、承認を得る。
- 当該施設は、
 「CRB/IRB・バイオバンク承認書類申請・確認画面」より、必要事項を入力した上で「IRB承認書のコピー」をアップロードする。
「CRB/IRB・バイオバンク承認書類申請・確認画面」より、必要事項を入力した上で「IRB承認書のコピー」をアップロードする。 - JCOGデータセンターは、当該施設の登録開始手続きを行い、当該グループメーリングリストにて「登録開始手続き完了メール」を配信する。
- 当該施設は、
 の受領後、
の受領後、 JCOG Web Entry System( https://secure.jcog.jp/dc/ )の「株式会社エスアールエル(SRL)への連絡」または「SRLへの採血管発注専用フォーム」よりメールを送信する。
JCOG Web Entry System( https://secure.jcog.jp/dc/ )の「株式会社エスアールエル(SRL)への連絡」または「SRLへの採血管発注専用フォーム」よりメールを送信する。  当該施設は、
当該施設は、 のSRLとの手続きが完了後、
のSRLとの手続きが完了後、 の試料登録を開始する。
の試料登録を開始する。
※施設IRBへの審査申請に際しては、 最新版の実施計画書であることをご確認の上、ご提出ください。
最新版の実施計画書であることをご確認の上、ご提出ください。
登録開始手続きにあたっての注意とお願い
- IRB承認書提出時の注意
IRB承認書のご提出の際には、必ず専用の 「CRB/IRB・バイオバンク承認書類申請・確認画面」よりアップロードしてください。(FAX/メールによる送付はお控えください)
「CRB/IRB・バイオバンク承認書類申請・確認画面」よりアップロードしてください。(FAX/メールによる送付はお控えください)
なお、「条件付き承認」で、かつ、IRB承認書中に「条件」について具体的な記載がない場合は、その内容を記載した文書をIRB承認書に添えていただくか、詳細を【通信欄】に入力してください。
その際、条件に関して不明点がある場合やその条件がJCOG臨床試験としての許容範囲を超える場合には、JCOGデータセンターから問い合わせをさせていただくことがございますのでご了承ください。
実施計画書改訂と実施計画書改正
「JCOG-バイオバンク・ジャパン連携バイオバンク実施計画書」の変更は、JCOG運営委員会での審査により「改訂」か「改正」かが決定されます。
改訂:バイオバンクに参加する患者の危険を増大させる可能性がなく、かつバイオバンクの運用に実質的な影響を及ぼさない実施計画書の変更。
例:ver.1.0 → ver.1.1
改正:バイオバンクに参加する患者の危険を増大させる可能性のある、またはバイオバンクの運用に実質的な影響を及ぼす実施計画書の部分的変更。
例:ver.1.0 → ver.2.0
参加施設のIRB承認については「ヒトゲノム・遺伝子解析研究に関する倫理指針(ゲノム指針)」および「人を対象とする医学系研究に関する倫理指針」に従って、審査を受けるようお願いします。審査形式(通常審査とするか迅速審査とするか)は医療機関の規定に従ってください。
- 実施計画書の改訂・改正時の再審査申請とIRB承認の連絡について
実施計画書の改訂・改正時には、各医療機関IRBへのバイオバンク実施継続の再審査申請が必要です。初回申請時と同様に、審査の形態については各医療機関のIRB事務局などとご相談ください。 - 実施計画書の改正時
改正実施計画書に対するIRB承認が得られた際には、初回申請時と同様の手順で、JCOGデータセンターへIRB承認書のコピーをご提出ください。 - 実施計画書の改訂時
JCOGデータセンターへのIRB承認書のコピーのご提出は不要です。
その他のページ
- TOP
- 【臨床研究法】本体研究の認定臨床研究審査委員会(以下「CRB」)承認と登録開始手続き
- 【人を対象とする生命科学・医学系研究に関する倫理指針】本体研究の一括審査IRB承認と登録開始手続き
- 【人を対象とする医学系研究に関する倫理指針】本体研究の施設IRB承認と登録開始手続き
- バイオバンクのIRB承認と登録開始手続き
- 附随研究のIRB承認と登録開始手続き
- PET/CT装置で撮像されたCT画像を適格性の判断や効果判定に用いる場合の手続き
- 患者登録
- CRF提出
- 定期モニタリング/追跡調査
- 有害事象報告/疾病等報告
- 施設訪問監査の受け入れ
- 研究グループメーリングリスト
- 研究者情報変更
- 医療機関情報変更/施設情報変更
- 副次的解析と附随研究
- FAQ